|
وبلاگ علمی و پژوهشی آنتروپی و انحلال مواد در آبکاهش آنتالپی و افزایش آنتروپی دو عامل موثر در خود به خود بودن فرآیند ها است. اگر انحلالی گرماگیر است و انجام می شود، حتماً افزایش آنتروپی به حدی است که گرماگیر بودن فرآیند را جبران کرده و انرژی آزاد منفی است. مثل انحلال نیترات آمونیوم در آب
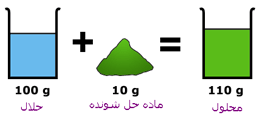
تغییر آنتروپی در فرآیند انحلال را می توان به صورت زیر بیان کرد:حل شدن جامد در مایع زیرا بلور منظم است و با حل شدن ملکول ها آزادی عمل بیشتری دارند و در محلول آزادانه حرکت می کنند.
حل شدن مایع در مایع زیرا ملکول های هر مایع در حجم بزرگتری حرکت می کنند.
حل شدن گاز در مایع
در حالت گاز آزادی عمل بیشتر است و در حالت مایع بین ملکول گاز و مایع جاذبه وجود دارد. پس آزادی عمل گاز کم می شود واکنش کلسیم اکسید با آب یک واکنش گرماده است. واکنش آمونیوم نیترات با آب یک نمونه از فرآیندهای خود به خودی است که در بسته های خنک کننده تجارتی از آن یا آمونیوم کلرید استفاده می شود. در این بسته ها مقدار کمی از این نمک ها به کمک یک غشاء نازک از آب جدا شده اند. وقتی این بسته لمس می شود . غشاء پاره شده و نمک در آب حل می شود. چون این واکنش گرما گیر است. گرما را از محیط جذب کرده و دستان شما خنک می شود.
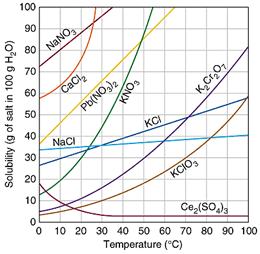
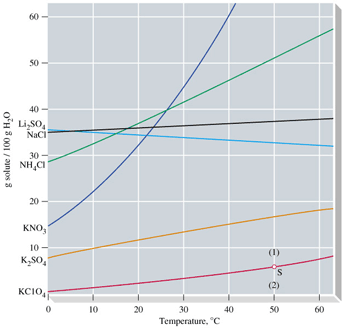
منحنی، انحلال پذیری منحنی است که میزان حل شدن یک ماده برای رسیدن به یک محلول اشباع در دماهای مختلف در 100 گرم آب نشان می دهد. برای رسیدن به یک محلول اشباع در یک دمای مشخص باید آنقدر از آن ماده در حلال در همان دما حل کنیم که دیگر حل نشود. شکل زیر یک محلول فوق اشباع را نشان می دهد که سرد شدن و در حال کریستالیزاسیون است.
اگر مشخصات محلول، نقطه ای را نشان دهد که روی منحنی است. آن محلول اشباع (سیر شده) است. اگر نقطه زیر خط باشد غیر اشباع و اگر بالای خط باشد فوق اشباع می باشد.
اگر منحنی صعودی باشد انحلال گرماگیر است و با افزایش دما، انحلال خواهد شد. اگر نزولی باشد، انحلال گرماده است که با افزایش دما انحلال کاهش می یابد. یک محلول فوق اشباع با کوچکترین تحریکی رسوب گذاری می کند.
انحلال پذیری مواد در آب بیش ترین مقدار از یک ماده که در دمای معین در 100 گرم آب حل می شود، انحلال پذیری آن ماده است. که عملاً یک در صد وزنی محلول اشباع است. در حالت اشباع بین حل شونده و حلال، تعادل برقرار می گردد.
جدول زیر انحلال پذیری برخی از مواد در آب را در دمای 20 درجه سانتیگراد نشان می دهد.
به طور عمومی ماده ای محلول است که با غلظت1/0 مولار یا بیشتر حل شود و نامحلول ماده ای است که با غلظت 0001/0 مولار یا کمتر حل شود. نظرات شما عزیزان:
درباره وبلاگ باسلام خدمت شما بینندگان این وبلاگ.امیدوارم تمام لحظاتی که در این وبلاگ هستیدپر از امید وشادی باشد.عزیزان مارا از نظرات وپیشنهادهای خود آگاه سازید. هادی محمدی نازلو آخرین مطالب نويسندگان موضوعات پيوندها
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
 افزایش آنتروپی
افزایش آنتروپی